
HIF (Factor de inducción de Hipoxia): La regulación de los niveles de oxígeno hace historia: Un premio Nobel que abre nuevos horizontes en la detección temprana, prevención, concientización y tratamiento del cáncer.
Hace unos días se anunció que el Premio Nobel de Medicina 2019 es para William Kaelin, Peter Ratcliffe y Gregg
Semenza por descubrir cómo las células saben y se adaptan a los niveles de oxígeno a su alrededor.
Un poco de historia:
En el siglo XVIII, Carl Sheele determinó que aproximadamente 1/4 del volumen del aire era “fuego de aire”; es decir, en la atmósfera existe un componente X absolutamente necesario que permite la combustión, o sea sin el aire no podemos quemar cosas.
Carl Wilhelm Scheele descubrió el oxígeno de forma independiente en Upsala en 1773, o incluso antes, y Joseph Priestley, en Wiltshire en 1774, pero el honor suele adjudicársele a Priestley debido a que publicó su trabajo antes. Antoine Lavoisier, cuyas investigaciones ayudaron a desacreditar la entonces popular teoría del flogisto de combustión y corrosión, acuñó el nombre «oxígeno» (O2) en 1777.
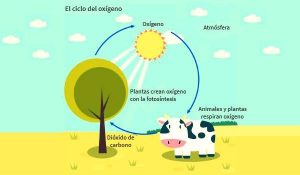 Décadas después se supo que el oxígeno es liberado por la fotosíntesis que realizan las plantas. Se encontró que en el cuerpo humano este elemento se transporta por una proteína, la hemoglobina. Y entendimos que el oxígeno es fundamental para nuestra comprensión de la vida.
Décadas después se supo que el oxígeno es liberado por la fotosíntesis que realizan las plantas. Se encontró que en el cuerpo humano este elemento se transporta por una proteína, la hemoglobina. Y entendimos que el oxígeno es fundamental para nuestra comprensión de la vida.
Además, sabíamos que los tejidos del cuerpo pueden verse privados de oxígeno en diferentes circunstancias: Ej: durante el ejercicio, durante un derrame cerebral, frente a trombos o coágulos, etc. Sin embargo, hasta los descubrimientos de Kaelin, Ratcliffe y Semenza, no estaba del todo claro cómo se regulaba esta adaptación en el nivel fundamental de la expresión génica. Entonces: ¿Cómo detectamos cuando hay poco o mucho oxígeno? ¿Qué mecanismos hay detrás de esa respuesta fisiológica a la falta de oxígeno?
En esta historia hay 2 protagonistas la Eritropoyetina y el factor inducible por hipoxia (HIF), formado por el factor inducible por hipoxia 1 (HIF-1α) y un activador de este factor al que llamaremos ARNT.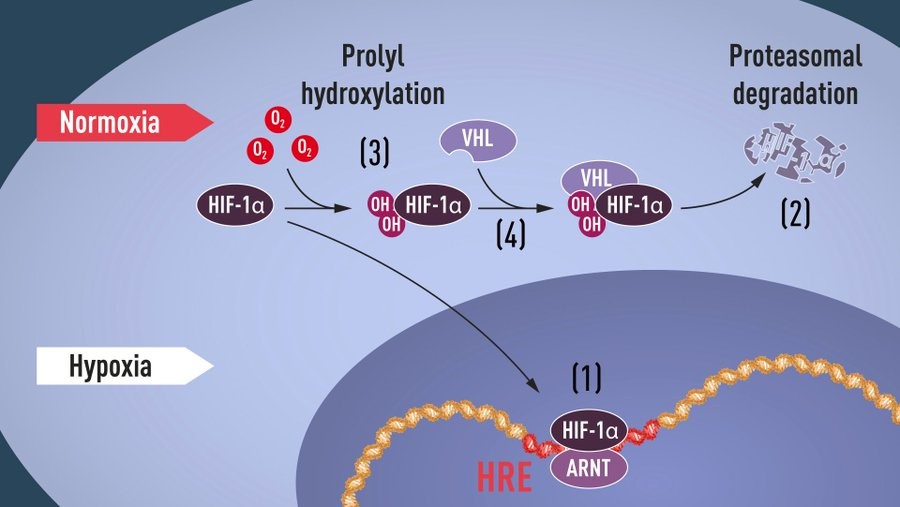
Semenza y Ratcliffe estudiaron cómo una hormona, llamada Eritropoyetina, responde a los bajos niveles de oxígeno, promoviendo la producción de glóbulos rojos y evitando la muerte celular. Es decir, la Eritropoyetina es encargada de actuar cuando hay hipoxia (poco O2). Entonces ¿quién le dice al gen de la Eritropoyetina que se debe de activar?
Semenza y sus colegas identificaron que juntito al gen de la eritropoyetina, existen segmentos específicos de ADN que median la respuesta a la hipoxia. Semenza aisló un complejo de dos proteínas que se unen justo a esta región de ADN, colectivamente llamadas factor inducible por hipoxia (HIF), que trabajan juntas para activar ciertos genes cuando el oxígeno es bajo en las células.
Entonces: baja el O2, el HIF se pega al gen de la eritropoyetina, activa su transcripción, se produce eritropoyetina y entonces esta hormona ya activa todos los mecanismos para resistir al bajo oxígeno. ¿quién regula al HIF-1α?
En esos años, muchos otros grupos de investigación descubrieron que cuando hay mucho oxígeno HIF-1α se degrada rápido, pero cuando hay poquito oxígeno HIF-1α casi no se degrada, entonces debe existir algo que se una al HIF-1α y así lo regule. La respuesta llegó a través de William Kaelin y Peter Ratcliffe que estudiaron un síndrome llamado Von Hippel-Lindau, que aumenta el riesgo de cáncer. Las familias con esta enfermedad tienen mutaciones en una proteína llamada VHL. Kaelin demostró que las células sin un gen VHL que funcione bien no pueden responder al O2. Sin embargo, cuando el gen VHL se reintroduce en las células cancerosas, se restablecen los niveles normales. Es decir que la proteína VHL está involucrada en el control de las respuestas a hipoxia.
Es así como se comprobó que la proteína VHL reportada por Kaelin interactúa con HIF reportado por Ratcliffe y Semenza, desactivando las respuestas a hipoxia al marcar su destrucción una vez que aumentan los niveles de O2. Esto concluyentemente vincula VHL a HIF.
Es decir, cuando hay poco O2, HIF-1α le informa a las células que están pobres de O2 produciendo eritropoyetina y activando mecanismos varios. Pero cuando se reestablecen los niveles de O2, VHL se le pega a HIF y provoca su degradación, dejando las cosas como antes estaban, o sea en homeostasis.
La búsqueda se centró en una porción específica de la proteína HIF-1α que se sabe que es importante para la degradación dependiente de VHL, y tanto Kaelin como Ratcliffe sospecharon que la clave para la detección de O2 residía en algún lugar de este dominio proteico.
En 2001, en dos papers simultáneos, se mostró que bajo niveles normales de oxígeno, se agregan grupos hidroxilo en dos posiciones específicas en HIF-1α. Esta modificación de la proteína, llamada prolil hidroxilación, permite que VHL reconozca y se una a HIF-1α y la degrade.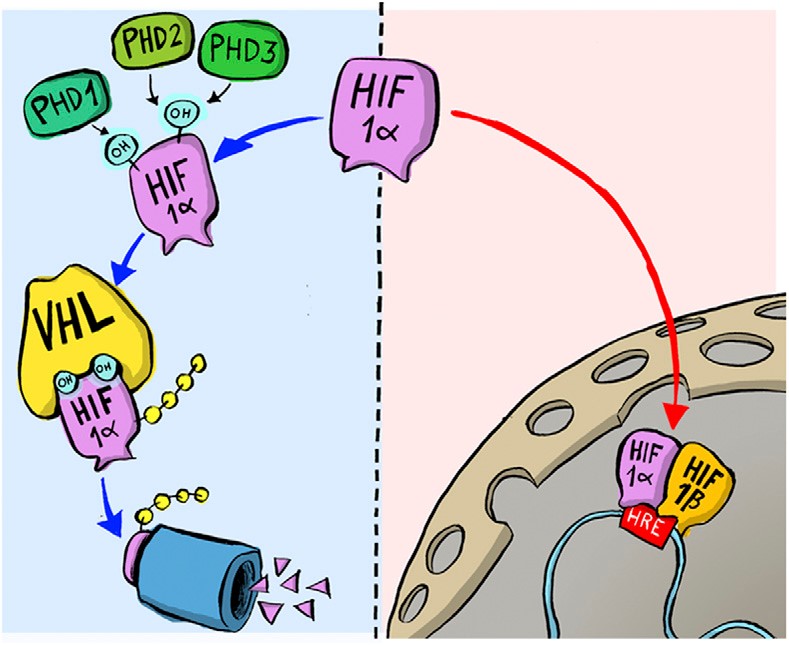
Por lo tanto, esto explica cómo los niveles normales de oxígeno controlan la degradación rápida de HIF-1α con la ayuda de enzimas sensibles al oxígeno (llamadas prolil hidroxilasas, más tarde identificadas).
Resumen: baja el oxígeno, HIF-1α activa la producción de Eritropoyetina, la Eritropoyetina activa mecanismos para combatir la hipoxia. Luego sube el oxígeno, se agregan grupos hidroxilos a una parte de HIF-1α y VHL entonces marca a HIF-1α para su degradación. Y todo como nuevo.
El trabajo ha ayudado a comprender cómo el cuerpo se adapta a los bajos niveles de oxígeno, así produciendo glóbulos rojos y desarrollando nuevos vasos sanguíneos. La capacidad de detectar O2 también es importante para el crecimiento adecuado de un feto y placenta en desarrollo.
Los investigadores también están tratando de desarrollar medicamentos contra el cáncer dirigidos a los procesos de detección de oxígeno.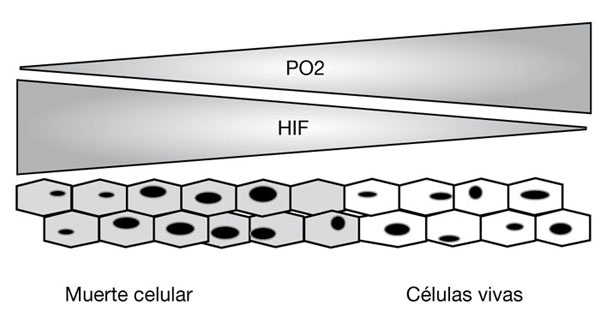
Dr. Niewiadomski, Dario
MN 110.535
Oncólogo clínico

